Tabla de contenidos
La materia viva está constituida por elementos químicos, en concreto por aquellos que conocemos como bioelementos. Los bioelementos se combinan entre sí y dan lugar a las biomoléculas, que se clasifican en dos grandes grupos: las biomoléculas inorgánicas y las biomoléculas orgánicas. En el primer grupo, en el de las biomoléculas inorgánicas, se encuentra el agua, presente tanto en el medio natural como en los organismos vivos. Las propiedades físicas y químicas del agua se deben a su estructura molecular.
La estructura de la molécula de agua
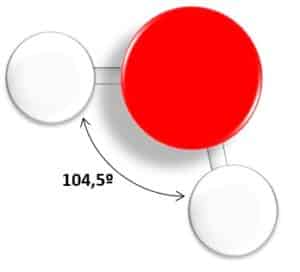
La molécula de agua es la más abundante en la materia viva, entre un 20% y un 90% en los seres vivos. Todos conocemos su fórmula química: H2O. Podemos observar que se encuentra formada por la unión de un átomo de oxígeno (O) y dos átomos de hidrógeno (H).
El átomo de oxígeno contiene en su capa de valencia seis electrones, con los que puede enlazar con los demás elementos. En la molécula, el oxígeno comparte dos electrones con los dos átomos de hidrógeno, un electrón con cada uno, mediante un modelo de enlace químico, llamado enlace covalente. Quedarán cuatro electrones a su alrededor sin enlazar, que se situarán al lado opuesto de los enlaces formados con los hidrógenos. Se forma pues, una molécula angular, cuyo ángulo del enlace H-O-H es de 104.5º.
Debido a su estructura, la molécula de agua se comporta como un dipolo eléctrico
A pesar de ser una molécula neutra, la molécula de agua se comporta como un dipolo eléctrico. Al ser la diferencia de electronegatividad entre el átomo de oxígeno y los átomos de hidrógeno elevada, el átomo de oxígeno atrae con más fuerza a los electrones compartidos en cada enlace covalente que los átomos de hidrógeno. Por tanto, el enlace entre el oxígeno y el hidrógeno está polarizado, y junto a los pares de electrones no compartidos, da lugar a una densidad de carga negativa en el oxígeno y una densidad de carga positiva en los hidrógenos. Tendremos que pensar en la molécula de agua como un dipolo permanente, con el polo negativo hacia el átomo de oxígeno y el positivo hacia los átomos de hidrógeno.
La polaridad de la molécula de agua permite que ésta pueda unirse a cuatro moléculas vecinas mediante enlaces intermoleculares, enlaces denominados puentes de hidrógeno.
Gracias a esta característica del agua, a su polaridad, las moléculas de esta sustancia en forma líquida dan lugar a una extensa red mantenida por los enlaces por puentes de hidrógeno, que están continuamente formándose y rompiéndose.
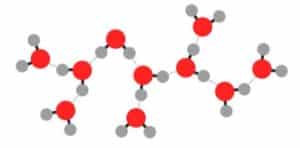
Cuando el agua se congela, los enlaces por puentes de hidrógeno, se hacen permanentes, y el agua adquiere una estructura cristalina que ocupa un mayor volumen que en estado líquido.
Al introducir una botella con agua en el congelador completamente llena, explota, debido al aumento de volumen del hielo respecto al agua.
Una botella tiene una cierta capacidad, y puede contener cierto volumen de líquido. Cuando el agua se expande en su interior al congelarse, se produce la ruptura de la botella debido al aumento de volumen del agua.
El hielo flota sobre el agua porque es menos denso que ella.
Cuando una masa de agua se congela, aumenta su volumen y, en consecuencia, disminuye su densidad. Al ser el hielo menos denso que el agua, flota sobre ella.
Más contenidos en www.loreseek.com
Síguenos en Twitter: @LoreSeekWeb y en Facebook: LoreSeekWeb
Estamos en Instagram: @loreseek