Tabla de contenidos
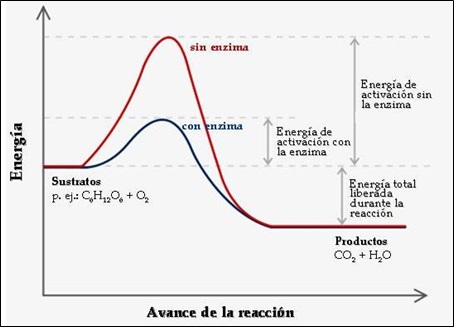
La mayoría de las enzimas son unas proteínas que catalizan de manera específica determinadas reacciones que se producen en los seres vivos. Se les llaman biocatalizadores naturales. Al conjunto de estas reacciones se les denomina metabolismo celular. Lo que hacen las enzimas es disminuir la energía que se necesita para que las reacciones se produzcan.
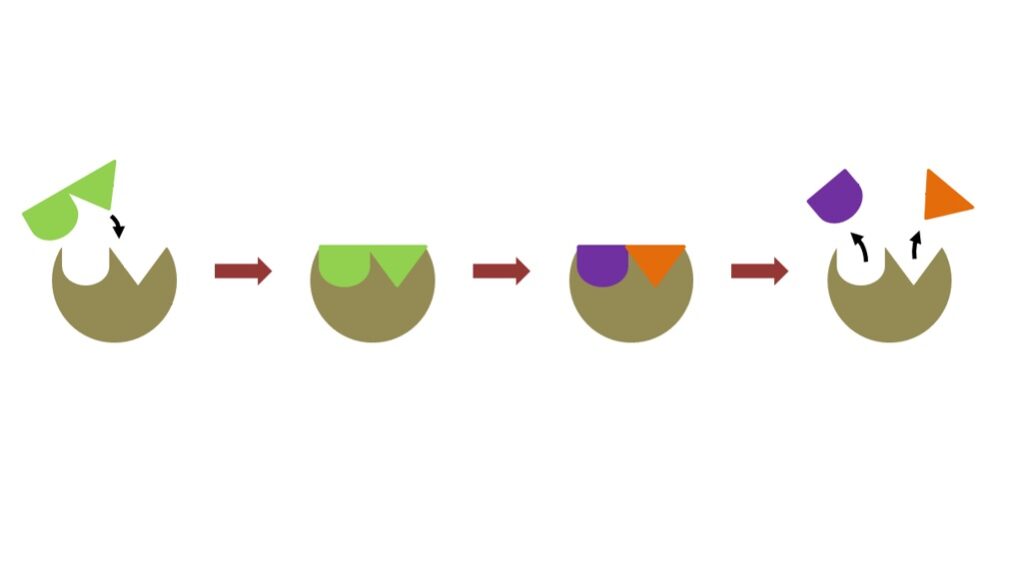
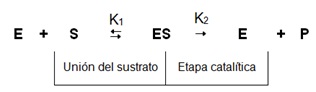
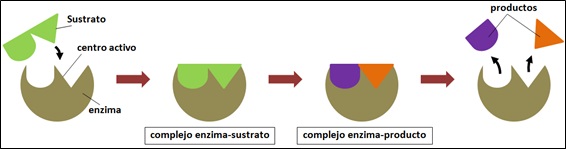
Para ello, la enzima se une a la molécula o catabolito que van a transformar. A esta molécula con la que se une, se la llama sustrato. Tras la reacción donde el sustrato se transforma en producto, se libera éste último, separándose de la enzima. En la reacción, no se consumen las enzimas. Es decir, tras la reacción, la enzima vuelve a quedar como estaba antes de la reacción.
Si las enzimas no realizasen su acción catalítica, las reacciones químicas en los organismos vivos serían tan lentas que el metabolismo de las células no podría desarrollarse.
Propiedades de las enzimas
La mayoría de las enzimas son proteínas, y tienen las siguientes propiedades:
- Son solubles en agua. Y son difusibles en los líquidos orgánicos.
- Se requieren en dosis mínimas. Son catalizadores, por lo que no sufren ningún cambio en la reacción.
- Tienen gran actividad. Pueden transformar un sustrato de masa molecular mucho mayor que ella.
- Son proteínas. Se alteran por calor, radiaciones, cambios de pH, etc.
- Especificidad de sustrato y de reacción. Esta propiedad se refiere a que una enzima determinada actúa sobre un único sustrato (o un reducido grupo de ellos) y cataliza solo un tipo de reacción.
Cinética enzimática
Las enzimas pueden realizar su función con los radicales R de sus aminoácidos. Algunas enzimas necesitan de un componente no proteico. Este componente es el cofactor. El conjunto enzima-cofactor se llama holoenzima. El cofactor puede ser un ion metálico (Fe2+, Mg2+, etc.) o un compuesto orgánico (NAD+, FAD, vitaminas). A los compuestos orgánicos no proteicos se le llama coenzima. Si el cofactor está unido mediante enlace covalente a la parte proteica o apoenzima, se le conoce como grupo prostético.
Las enzimas poseen en su superficie una zona activa, a la que se adapta perfectamente el sustrato que presente la geometría complementaria: su centro activo. Éste es su centro catalítico.
Dos son los modelos de acoplamiento del sustrato con la enzima:
- Modelo llave-cerradura. Las enzimas solo puede unirse con su correspondiente sustrato. Es decir, la enzima es la “cerradura” y el sustrato es la “llave”.
- Modelo de acoplamiento inducido. El sustrato hace que se produzca un cambio conformacional específico en el centro activo. En este caso, tanto el sustrato como la enzima se distorsionan.
Inhibición enzimática
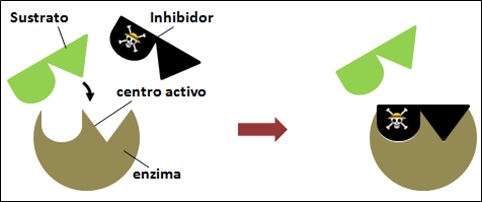
Hay sustancias que se llaman inhibidores enzimáticos. Los venenos, son un ejemplo. Los inhibidores disminuyen parcial o totalmente la actividad de una enzima. Como consecuencia, disminuye o se anula la velocidad de la reacción catalizada. Por ejemplo, impiden que el sustrato se pueda unir al centro activo de la enzima donde se debe unir para que se produzca la reacción.
Hay dos tipos de inhibición enzimática. La irreversible y la reversible.
En la inhibición irreversible se modifica o se destruye el enzima. La enzima no puede recuperar su actividad.
En la inhibición reversible, el complejo enzima-inhibidor puede disociarse y volver a actuar.
Puede distinguirse entre inhibición competitiva e inhibición no competitiva:
- Inhibición competitiva. El inhibidor y el sustrato son moléculas parecidas y compiten por el centro activo.
- Inhibición no competitiva. El inhibidor no interacciona con el centro activo, sino con otros grupos del enzima. Suele producir una modificación en la conformación del enzima, lo que impide la unión del sustrato. Puede, además, unirse al enzima o al complejo enzima-sustrato.
Clasificación de las enzimas
A continuación proponemos una clasificación de las enzimas, según acción.
- Óxido-reductasas. Transfieren electrones en reacciones redox. Por ejemplo, las oxidasas e hidrogenasas en la cadena respiratoria.
- Transferasas. Estas transfieren grupos funcionales entre sustratos. Por ejemplo, las transaminasas, fosfotrransferasas…
- Hidrolasas. Participan en reacciones de hidrólisis, como en los procesos digesitivos. Algunos ejemplos son las lipasas, glucosidasas, amidasas…
- Liasas. En reacciones de rotura y unión de sustratos sin acción del agua. Este es el caso de las
- Las isomerasas transforman un sustrato en otro, isómero del primero.
- Ligasas o sintetasas. Participan en las reacciones de unión de moléculas.
Más contenidos en www.loreseek.com
Síguenos en Twitter: @LoreSeekWeb y en Facebook: LoreSeekWeb
Estamos en Instagram: @loreseek